
Contenido
El punto de evaporación de las sustancias varía dependiendo de su estructura a nivel molecular. Todos son familiares con el punto de evaporación del agua en condiciones normales de presión - 100 grados Celsius o 212 Farenheit. Muchas de las sustancias que usted piensa como gas, sin embargo, son gases apenas porque su punto de evaporación está muy por debajo de la temperatura ambiente. Hasta algunas sustancias que son líquidas a temperatura ambiente, como el etanol, tienen punto de evaporación menor que el agua.
atmósfera
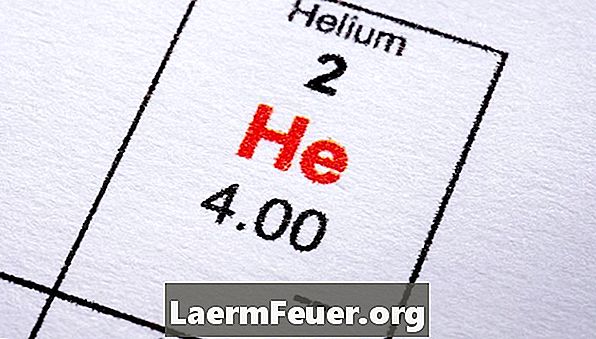
El nitrógeno (N2), el dióxido de carbono, el oxígeno (O2), el helio, el cloro (Cl2), el hidrógeno, son ejemplos comunes de sustancias que se evaporan a temperaturas mucho menores que el agua. El helio líquido tiene el menor punto de evaporación de todos - alrededor de -452 Farenheit, sólo 4.2 grados Celsius por encima del cero absoluto. A pesar de que estas sustancias se llaman gases, es importante saber que ninguna sustancia puede definirse como "gas" o "líquido", excepto a una temperatura determinada. Líquido, sólido y gaseoso son sólo estados diferentes de la materia, y una sustancia puede estar en cualquiera de estos tres estados, dependiendo de la temperatura y la presión.
Hidrocarburos apolares
El agua tiene un momento dipolar, lo que significa que es polar porque tiene una carga débil parcial en el oxígeno y una carga débil parcial en el hidrógeno. Los hidrocarburos como los hallazgos en la gasolina, sin embargo, son apolares. Las interacciones llamadas de fuerzas de Londres mantienen moléculas apolares juntas en las fases líquida y sólida. Estas fuerzas se vuelven más grandes a medida que el tamaño de la molécula aumenta. En consecuencia, muchas moléculas apolares menores como las que componen la gasolina se evaporan a temperaturas menores que la del agua debido al hecho de que las interacciones intramoleculares son más débiles.
alcoholes
Así como las moléculas de agua, alcoholes también son polares y pueden formar un tipo especial de unión llamada puente de hidrógeno. Las moléculas de agua, sin embargo, pueden formar dos puentes de hidrógeno, mientras que el alcohol sólo puede formar una. Tienden a tener el punto de evaporación mayor que los hidrocarburos del mismo tamaño, pero un punto de ebullición menor que el agua. Es así como se hace whisky: a través de la destilación para aumentar el grado alcohólico.
Otras moléculas
Muchas otras moléculas tienen el punto de evaporación más pequeño que el del agua. Un ejemplo notable es una clase de moléculas llamadas éteres, que tienen un oxígeno ligado a dos carbono. Ellas son ligeramente polares, pero no tan polares como el agua y los alcoholes, y no pueden formar puentes de hidrógeno, teniendo normalmente un punto de evaporación menor. Otro ejemplo es el amoníaco que se vende generalmente disuelto en agua. Se evapora por debajo de 0 grados Celsius y, a temperatura ambiente, es un gas, aunque se disuelve rápidamente.