Contenido
- Número de electrones en la capa de valencia
- Paso 1
- Paso 2
- Paso 3
- Paso 4
- Estructura de Lewis
- Paso 1
- Paso 2
- Paso 3
- Carga formal de cada átomo
- Paso 1
- Paso 2
- Paso 3
Al determinar la carga formal de una molécula como el CoCl2 (gas fosgeno), es necesario conocer el número de electrones en la capa de valencia de cada átomo y la estructura de Lewis de la molécula.
Número de electrones en la capa de valencia
Paso 1
Busque cada átomo en la tabla periódica de elementos para determinar el número de electrones en la capa de valencia.
Paso 2
Recuerde que dos electrones están en el primer subnivel s, dos están en el segundo subnivel s, seis electrones en el primer subnivel p, etc. Recuerde: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
Paso 3
Golpea la carga. Si la molécula es un ion, sume o reste uno o más electrones del total para llegar a la carga final.
Paso 4
Para CoCl2 (gas fosgeno): C = 4; O = 6; Cl = 7. La molécula no está ionizada y tiene carga neutra. Por lo tanto, el número total de electrones en la capa de valencia es 4 + 6 + (7x2) = 24.
Estructura de Lewis
Paso 1
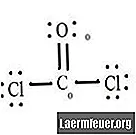
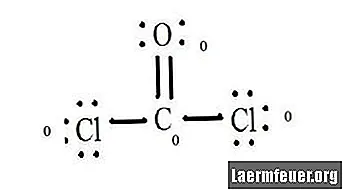
Vea el diagrama de la estructura de Lewis del CoCl2 (gas fosgeno). La estructura de Lewis representa la estructura más estable y probable de la molécula. Los átomos son atraídos por pares de electrones de valencia; se forman enlaces entre electrones libres para satisfacer la regla del octeto.
Paso 2

Dibuja cada átomo y sus electrones de valencia y luego forma enlaces según sea necesario.
Paso 3
Los átomos de cloruro comparten enlaces simples con la molécula de carbono, mientras que el átomo de oxígeno forma un doble enlace con el carbono. Cada átomo de la estructura final satisface la regla del octeto y tiene ocho electrones en la capa de valencia, lo que permite la estabilidad molecular.
Carga formal de cada átomo
Paso 1
Cuente los pares libres de electrones de cada átomo en la estructura de Lewis. A cada átomo se le asigna un electrón de cada enlace en el que participa. Suma esos números. En CoCl2: C = 0 pares libres más 4 electrones de enlaces = 4 electrones. O = 4 electrones de pares libres más 2 electrones de enlaces = 6 electrones. Cl = 6 electrones de pares libres más un electrón de un enlace con C = 7 electrones.
Paso 2
Reste la cantidad de electrones en la capa de valencia en el átomo libre. El resultado es la carga formal de cada átomo. En CoCl2: C = 4 electrones de valencia (ev) en el átomo no ligado menos 4 electrones designados en la estructura de Lewis (LS) = 0 carga formal O = 6 ev - 6 LS = 0 carga formal Cl = 7 ev - 7 LS = 0 carga formal
Paso 3
Al escribir, coloque estas cargas cerca de los átomos en la estructura de Lewis. Si la molécula tiene una carga en total, coloque la estructura de Lewis entre paréntesis con la carga escrita en el exterior en la esquina superior derecha.