
Contenido
- función
- estructura
- La importancia de la catalasa
- Factores que afectan la efectividad de la catalasa
- Otros usos de la catalasa
La catalasa es una enzima encontrada en las células de los animales, plantas y bacterias aeróbicas. Una enzima es una molécula grande, sintetizada en las células y producida para actuar como un catalizador en una reacción. Cada tipo de enzima desempeña una función específica, y la función de la catalasa es convertir un subproducto potencialmente nocivo en elementos útiles para la célula.

función
La catalasa, como la mayoría de las enzimas, es una proteína. Se encuentra en los peroxisomas, que son organelas celulares membranosas. La catalasa tiene una función biológica importante: cataliza la quiebra del peróxido de hidrógeno, una sustancia tóxica para los organismos, en agua y oxígeno molecular, que son ambos inofensivos y útiles.

estructura
La estructura en forma de halter de la catalasa contiene cuatro cadenas polipeptídicas, cada una conteniendo más de 500 aminoácidos. La catalasa también presenta cuatro grupos heme, que están hechos de anillos de protoporfirina, conteniendo un solo átomo de hierro. Estos anillos están abrigados dentro de las cuatro cadenas.
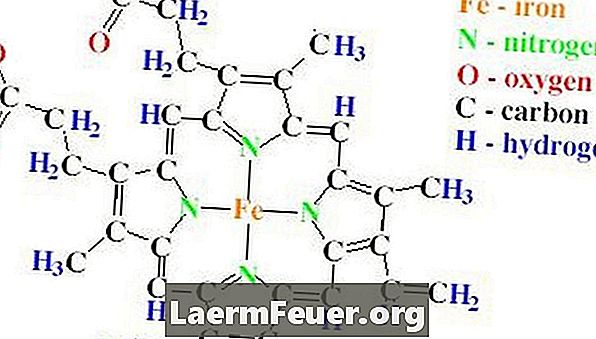
La importancia de la catalasa
El peróxido de hidrógeno es un subproducto de muchas funciones biológicas de los organismos. Todos los organismos aeróbicos utilizan oxígeno en la respiración. La reducción del oxígeno en agua es a menudo incompleta, y un electrón extra de un ion metálico puede ser transferido, causando la formación del peróxido. Sin embargo, la mayor parte del peróxido de hidrógeno se crea durante la producción de ATP, en la mitocondria. Aunque el peróxido de hidrógeno es tóxico para las células vivas, la reacción para romperlo de nuevo en el agua y el oxígeno ocurre rápida y efectivamente. La catalasa es conocida como una de las enzimas más eficientes, presentada un "turnover" cerca de 200.000 de eventos / segundo / subunidad. Sin la catalasa para aumentar la tasa de las reacciones, el peróxido de hidrógeno sobraría, dañando las células.
Factores que afectan la efectividad de la catalasa
La catalasa y su tasa de actividad se alteran por varios factores, incluyendo temperatura, pH, concentración de sal, cantidad de sustrato y la presencia de inhibidores o activadores. La temperatura es un factor importante en todas las reacciones bioquímicas, ya que la alta temperatura puede causar la desnaturalización de las enzimas. Cuando la enzima desnaturaliza, cambia su conformación, haciendo que el sustrato se ligue con menor eficiencia, y por lo tanto disminuyendo la tasa de reacción. Por otro lado, hasta que la temperatura máxima (que es diferente para cada tipo de catalasa) sea alcanzada, la tasa de reacción aumentará junto con la temperatura. El pH, la medida de la acidez o de la concentración de iones de hidrógeno en una solución, se mide en una escala de 0 a 14. Conforme la solución se vuelve más ácida (por debajo de 7), la enzima puede obtener un ion de hidrógeno de la solución , y según la solución se vuelve más básica (por encima de 7), puede perder un ion de hidrógeno. Cualquiera de estos extremos puede reducir la tasa de reacción, ya que cambian las conexiones químicas de la catalasa. Existen dos tipos de inhibidores: inhibidores no competitivos, que se unen a un sitio que no es el sitio activo, e inhibidores competitivos, que se unen al sitio activo de la catalasa. El sulfato de cobre es un conocido inhibidor no competitivo de la catalasa, y el cianuro se conoce como un inhibidor competitivo. En general, según la cantidad de peróxido de hidrógeno aumenta, la tasa de reacción también aumentará. Sin embargo, las reacciones enzimáticas siguen la ecuación de Michaelis-Menten, que dice que toda reacción alcanzará un punto de saturación, significando que en una tasa de reacción máxima, la adición de más sustrato dejará de tener efecto.
Otros usos de la catalasa
Como la catalasa está presente en prácticamente todos los organismos vivos, es una de las enzimas más estudiadas. Esto llevó a los científicos a encontrar otras funciones para esta eficiente enzima. La catalasa se utiliza para tratar la parte de dentro de los plásticos para embalar los alimentos. Previene la oxidación, y por lo tanto ayuda a conservar la comida. La catalasa también se utiliza durante el proceso de esterilización en frío, que es un proceso para preservar la leche y el queso, a través del tratamiento con peróxido de hidrógeno. Esta enzima se utiliza para eliminar cualquier traza remanente de peróxido de hidrógeno.