Contenido
- instrucciones
- Número de electrones en la capa de valencia
- Estructura de Lewis
- Carga formal de cada átomo
- advertencia
- Qué necesitas
Al determinar la carga formal de una molécula como el CoCl2 (gas fosgeno), es necesario saber el número de electrones en la capa de valencia de cada átomo y la estructura de Lewis de la molécula.
instrucciones
-
Busque cada átomo en la tabla periódica de los elementos para determinar el número de electrones en la capa de valencia.
-
Recuerde que dos electrones están en el primer subnivel s, dos están en el segundo subnivel s, seis electrones en el primer subnivel p, etc. Recuerde: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Ajuste la carga. Si la molécula es un ion, añada o reste uno o más electrones del total para llegar a la carga final.
-
Para el CoCl2 (gas fosgeno): C = 4; O = 6; Cl = 7. La molécula no es ionizada y tiene carga neutra. Por lo tanto, el número total de electrones en la capa de valencia es 4 + 6 + (7x2) = 24.
Número de electrones en la capa de valencia
-
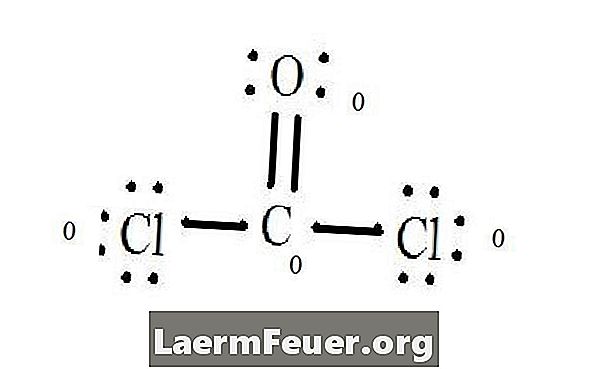
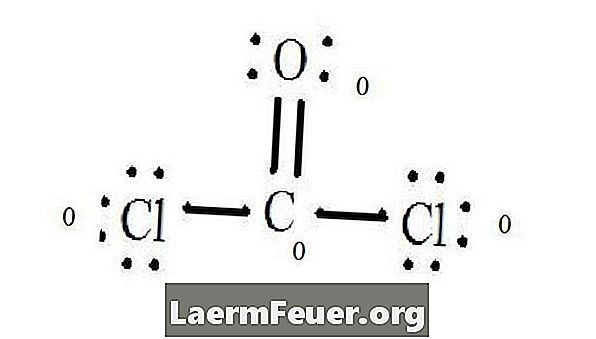
Vea el diagrama de la estructura de Lewis del CoCl2 (gas fosgeno). La estructura de Lewis representa la estructura más estable y probable para la molécula. Los átomos se tiran con electrones de valencia pareados; las conexiones se forman entre los electrones libres para satisfacer la regla del octeto.
-
Dibuje cada átomo y sus electrones de valencia y luego forme conexiones de acuerdo con la necesidad.
Los electrones diseñados en la estructura de Lewis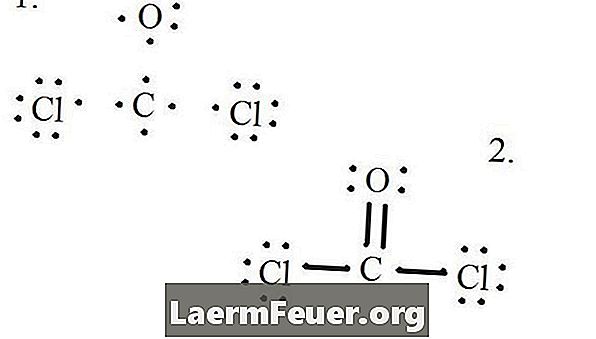
-
Los átomos del cloruro comparten enlaces simples con la molécula de carbono, mientras que el átomo de oxígeno forma unión doble con el carbono. Cada átomo en la estructura final satisface la regla del octeto y tiene ocho electrones en la capa de valencia, permitiendo estabilidad molecular.
Estructura de Lewis
-
Cuente los pares libres de electrones de cada átomo en la estructura de Lewis. A cada átomo designe un electrón de cada conexión de la que participa. Añada estos números. En el CoCl2: C = 0 pares libres más 4 electrones de conexiones = 4 electrones. O = 4 electrones de pares libres más 2 electrones de conexiones = 6 electrones. Cl = 6 electrones de pares libres más un electrón de una conexión con C = 7 electrones.
-
Reste la cantidad del número de electrones en la capa de valencia en el átomo no conectado. El resultado es la carga formal para cada átomo. En el CoCl2: C = 4 electrones de valencia (ev) en el átomo no conectado menos 4 electrones designados en la estructura de Lewis (LS) = 0 carga formal O = 6 ev - 6 LS = 0 carga formal Cl = 7 ev - 7 LS = 0 carga formal
Cargas formales de los átomos
-
Al escribir, coloque esas cargas cerca de los átomos en la estructura de Lewis. Si en el total la molécula tiene una carga, coloque la estructura de Lewis entre paréntesis con la carga escrita del lado de afuera en la esquina superior derecha.
Carga formal de cada átomo
advertencia
- El cálculo de la carga formal para las moléculas que contienen metales de transición puede ser traicionero. El número de electrones en la capa de valencia para metales de transición serán aquellos fuera del patrón de los gases nobles.
Qué necesitas
- Tabla periódica de los elementos